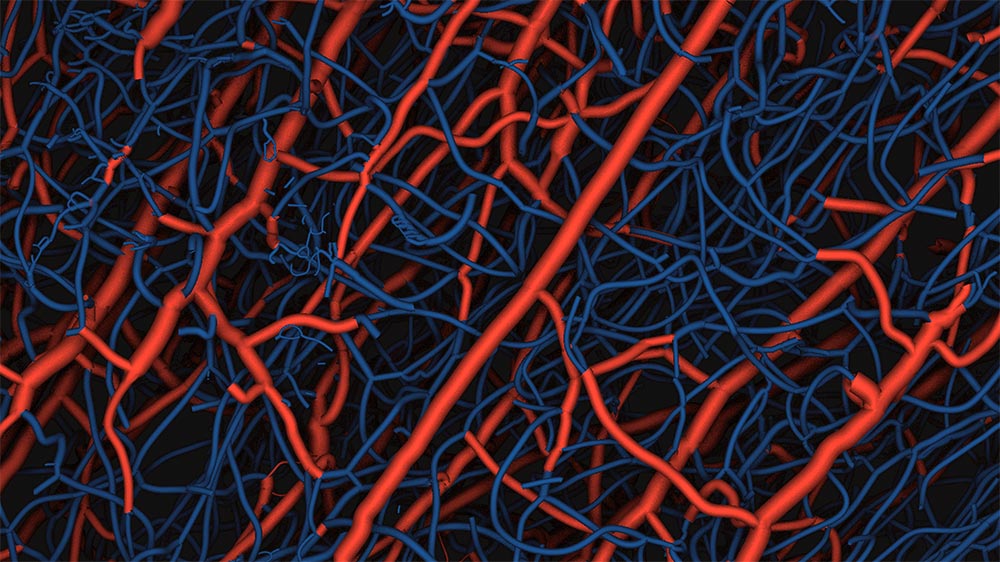
Darstellung der Blutgefässe im Mausgehirn: Wird Nogo-A unterdrückt, bilden sich neben grösseren Gefässen (rot) zusätzliche Kapillaren (blau). ©Universität Zürich - UZH
Universität Zürich – UZH – Neurowissenschaften – Mehr Blutgefässe im Gehirn – Stefan Stöcklin
Das Signalmolekül Nogo-A ist als Hemmer des Nervenzellwachstums bekannt. Nun zeigt der Hirnforscher und angehende Neurochirurg Thomas Wälchli, wie es die Bildung von feinen Blutgefässen im Gehirn unterdrückt.
Vor einigen Jahren hat das Forschungsteam um Martin Schwab, Professor für Neurowissenschaften am Institut für Hirnforschung der UZH und am Departement Gesundheitswissenschaften der ETHZ, das Eiweissmolekül Nogo-A entdeckt. Mit dem bahnbrechenden Befund wurde erstmals ein körpereigener Stoff bekannt, der das Wachstum von Nervenzellen im Zentralnervensystem (ZNS) bremst. 2017 beginnt eine europaweite klinische Studie (Phase ll) mit Querschnittgelähmten, in denen eine Therapie getestet wird, die auf der Blockierung dieser molekularen Bremse beruht.
Parallel zu diesen klinischen Tests wird das Eiweissmolekül aber auch intensiv auf seine Funktionen während der Entwicklung des Gehirns erforscht. Denn vor wenigen Jahren wurde entdeckt, dass die Signale aussprossender Nerven auch wachsende Blutgefässe beeinflussen, darunter Nogo-A. Eine eindrückliche und molekulare Bestätigung übrigens von anatomischen Befunden, die über 500 Jahre alt sind. Bereits damals ist dem belgischen Anatom Andreas Vesalius aufgefallen, dass Nerven und Gefässe in ähnlichen Bahnen verlaufen.
Wechselwirkung zwischen Nerven und Blutgefässen
Thomas Wälchli, Hirnforscher und Assistenzarzt für Neurochirurgie, hat sich diesem «faszinierenden» Forschungsgebiet an der Schnittstelle zwischen Nerven- und Gefässbildung verschrieben. «Es geht uns um ein besseres Verständnis der Angiogenese im Gehirn, also der Neubildung von Blutgefässen im Zentralnervensystem (ZNS)», sagt Wälchli.
Dazu führt er neben seiner Tätigkeit als neurochirurgischer Assistenzarzt eine kleine Forschungsgruppe an der Klinik für Neurochirurgie des Universitätsspitals Zürich (Professor Luca Regli) sowie am Institut für Regenerative Medizin der UZH (Professor Simon Hoerstrup). Unter dem Thema «CNS angiogenesis and neurovascular link» untersucht er die Wirkungen von Nogo-A und anderer Faktoren auf wachsende Blutgefässe.
Nun zeigt der Arzt in einer eindrücklichen Publikation, wie stark der nervenhemmende Faktor Nogo-A die Bildung neuer Blutgefässe im Gehirn effektiv beeinflusst. Diese Ergebnisse wurden soeben in der renommierten Fachzeitschrift Journal of Cerebral Blood Flow and Metabolism (JCBFM) publiziert.
Obwohl das Gehirn das Organ des Körpers mit dem höchsten Energieverbrauch ist, weiss man über die Blutversorgung und speziell die Gefässbildung erstaunlich wenig. Als Hirnforscher interessiert sich Thomas Wälchli grundsätzlich für die molekularen Prozesses der Gefässbildung im Gehirn. Als forschender Chirurg interessieren ihn auch die möglichen klinischen Anwendungen dieser Forschungserkenntnisse.
Tumore und Schlaganfälle
Denn die Angiogenese spielt bei schweren Erkrankungen wie zum Beispiel Hirntumoren eine entscheidende Rolle. Ein aggressiver Tumor könnte ohne die Bildung zusätzlicher Gefässe, die das hungrige Gewebe mit Nährstoffen und Sauerstoff versorgen, nicht wuchern. Andererseits ist die Angiogenese auch bei der Regeneration von Hirngewebe wichtig, zum Beispiel nach einem Schlaganfall. «Unsere Arbeiten betreffen drei Aspekte der ZNS-Angiogenese: Hirn-Entwicklung, Hirntumoren und Regeneration von Hirngefässen», sagt Wälchli.
-

- Thomas Wälchli will mit seinen Arbeiten die Therapien von Hirnerkrankungen verbessern. (Bild: zVg)
Seine Veröffentlichung ermöglicht nun interessante Einblicke in das komplexe Geschehen. Wie im Fall der Nervenzellen wirkt Nogo-A auch bei Gefässzellen als Bremse. Erst die Inaktivierung des Moleküls, das in der Membran der umgebenden Nervenzellen sitzt, führt zum Wachstum der Blutgefässe.
Diese neurovaskuläre Regulation – also die Interaktion zwischen Nogo-A der Nervenzellen und Blutgefässen – läuft ausserordentlich differenziert ab. «Wenn die Bildung von Nogo-A unterdrückt wird, bleibt das Grundgerüst der grösseren Gefässe weitgehend konstant, aber dazwischen bilden sich zusätzliche Kapillaren», sagt Wälchli. Bei Inaktivierung von Nogo-A bilden sich also zusätzliche Netzwerke haarfeiner Blutgefässe, welche in das bereits existierende dreidimensionale Blutgefässnetzwerk integriert werden.
Verdoppelung des kapillaren Netzwerks
Dies zeigten Versuche mit Knock-out Mäusen, bei denen das Gen für Nogo-A ausgeschaltet wurde. Mit neuen High-Tech-Methoden ist es Wälchli und seinen Mitarbeitern gelungen, die vermehrte Bildung von Kapillargefässen in den Gehirnen sichtbar zu machen. Dazu nötig waren unter anderem spezielle Untersuchungen mit Synchotron-Strahlung am Paul-Scherrer-Institut in Villigen und spezielle Algorithmen zur Bildanalyse.
Sie zeigen, wie sich die Anzahl von Hirngefässen in bestimmten Hirnregionen um bis zu 50 Prozent sowie das kapillare Mikronetzwerk um nahezu 100 Prozent vergrösserten. Dies ist insbesondere deshalb interessant, weil die Kapillargefässe sowohl bei der Regeneration von Hirngewebe wie auch beim Wachstum von Hirntumoren eine entscheidende Rolle spielen. «So könnte durch die Beeinflussung von Nogo-A im Gehirn zum Beispiel die Regeneration von Hirngewebe nach einem Schlaganfall verbessert werden», kommentiert Martin Schwab. Entsprechende Patente sind bereits angemeldet worden, präklinische Versuche am Laufen.
Stimulierende und bremsende Faktoren
Als Mediziner ist Wälchli voller Hoffnung, die Forschungsergebnisse dereinst auch in der klinischen Praxis nutzen zu können.
«Das grundlegende Verständnis der Blutgefässregulation im Gehirn weist eine sehr hohe klinische und translationale Relevanz auf», bestätigt Simon Hoerstrup. Bis es zu klinischen Anwendungen der Forschungsergebnisse kommt, dürfte allerdings noch einige Zeit vergehen. «Wir sind erst am Anfang, es gibt noch sehr viel zu tun», kommentiert der Jungforscher Wälchli. Denn so vielversprechend die Ergebnisse sind, so klar ist auch, dass Nogo-A nicht der einzige Spieler bei der Gefässneubildung im Gehirn ist. So weiss man , dass weitere stimulierende oder bremsende Faktoren involviert sind, welche den komplexen Prozess des Gefässwachstums im Gehirn regulieren.
Zudem sind die neuen Erkenntnisse aus dem Maushirn womöglich nicht eins zu eins auf Menschen übertragbar. «Erste Experimente mit Gefässzellen aus humanen Hirntumoren zeigen allerdings, dass Nogo-A auch auf diese Zellen eine hemmende Wirkung ausübt“, betonen Wälchli und Regli. Diese Resultate sind Motivation genug, die interdisziplinären Arbeiten weiterzuführen.
Denn sollten sich die neuen Befunde beim Menschen bestätigen, ergeben sich für Nogo-A neue Anwendungen für wichtige Krankheiten und Störungen.
 EN
EN